來自REGENXBIO Inc.的研究人員近日發(fā)表了題為“Advances in Recombinant Adeno-Associated Virus Production for Gene Therapy”的文章。本文為原文內(nèi)容簡介,詳細(xì)內(nèi)容,請參考原文。
重組腺相關(guān)病毒 (rAAV) 是用于遞送遺傳物質(zhì)、以進(jìn)行基因治療的主要載體,但其低產(chǎn)量和產(chǎn)品質(zhì)量導(dǎo)致高生產(chǎn)成本,目前,這仍然是該領(lǐng)域的主要挑戰(zhàn)。在本文中,我們總結(jié)了常用平臺(tái)的最新進(jìn)展,包括 HEK293、桿狀病毒、HSV 和基于 HeLa 的 rAAV 生產(chǎn)方法。文章詳細(xì)介紹了提高產(chǎn)量和產(chǎn)品質(zhì)量的每種方法和策略的優(yōu)勢和主要挑戰(zhàn)。
近年來,基于 rAAV 的基因治療獲得了很多關(guān)注,因?yàn)樗哂袔讉€(gè)理想的屬性,包括缺乏致病性和低免疫原性。基于 rAAV 的載體靶向分裂和非分裂細(xì)胞,包括視網(wǎng)膜、肝臟、心臟、肌肉和中樞神經(jīng)系統(tǒng) (CNS), 允許治療基因的長期表達(dá)。迄今為止,已針對(duì)各種疾病進(jìn)行了 200 多項(xiàng)臨床試驗(yàn),例如血友病 A 和 B、帕金森病、濕性年齡相關(guān)性黃斑變性、粘多糖貯積癥 (MPS)、巴頓病等。2012 年,開發(fā)用于治療反向脂蛋白脂肪酶缺乏癥 (LPLD) 的脂基因tiparvovec 成為歐洲第一個(gè)獲批的基因治療藥物。之后,另外2種基因治療產(chǎn)品獲得了美國食品藥品監(jiān)督管理局(FDA)的批準(zhǔn),包括 2017 年批準(zhǔn) voretigene neparvovec ,用于治療 Leber 先天性黑蒙,以及2019年批準(zhǔn)onasemnogene abeparvovec,用于治療脊髓肌肉萎縮 (SMA)。
盡管基于 rAAV 的基因療法的臨床試驗(yàn)取得了成功,但由于產(chǎn)量低以及某些疾病適應(yīng)癥的高劑量需求,高生產(chǎn)成本仍然是基因治療領(lǐng)域的瓶頸。Onasemnogene abeparvovec 單劑量治療費(fèi)用為 210 萬美元,是美國市場上最昂貴的藥物之一。另一個(gè)例子是,治療 X 連鎖肌管肌病 (XLMTM) 需要每公斤 10^14 載體基因組 (vg/kg) ,每個(gè)患者至少需要 10^15 vg。盡管最近的工藝和技術(shù)發(fā)展已將產(chǎn)量提高到 10^11 至 10^12 vg/L,并降低了商品成本,上游產(chǎn)量仍不足以滿足XLMTM等疾病的大劑量需求。
腺相關(guān)病毒生物學(xué)
野生型腺相關(guān)病毒 (AAV) 是 Atchison 等人于 1965 年偶然發(fā)現(xiàn)的,即電子顯微鏡觀察到了腺病毒制劑中 包含的25 nm 小污染性顆粒。它需要腺病毒進(jìn)行復(fù)制,后來被分類為無囊膜病毒的細(xì)小病毒科。野生型 AAV 包含一個(gè) 4.7 kb 的單鏈 DNA 基因組,跨越2個(gè)主要開放閱讀框 (ORF),兩側(cè)是兩個(gè) T 形反向末端重復(fù)序列 (ITR)(圖 1)。反向末端重復(fù)具有復(fù)制蛋白結(jié)合元件 (RBE) 和末端解析位點(diǎn) (TRS),其參與復(fù)制、衣殼中的基因組包裝和長期細(xì)胞內(nèi)持久性。第1個(gè)開放閱讀框 (rep) 包含 P5 和 P19 啟動(dòng)子,并通過可變剪接編碼4種復(fù)制蛋白(根據(jù)分子量,命名為 Rep78、Rep68、Rep52、和 Rep40 后的分子量)(圖 1)。Rep78 和 Rep68 的表達(dá)受 P5 啟動(dòng)子的調(diào)節(jié)。它們是 DNA 復(fù)制、位點(diǎn)特異性整合、基因表達(dá)調(diào)控以及從宿主基因組中切除所必需的。P19 啟動(dòng)子調(diào)控 Rep52 和 Rep40 的表達(dá)。Rep52 和 Rep40 都具有 3' 到 5' 的解旋酶活性,對(duì) AAV 基因組包裝很重要。第2個(gè)開放閱讀框(帽)包含 P40,1個(gè)控制3個(gè)衣殼蛋白亞基(即 VP1、VP2和VP3)表達(dá)的啟動(dòng)子,后者分子量分別為 87、72 和 62 kDa。VP1、VP2 和 VP3 的羧基末端蛋白質(zhì)序列相同。
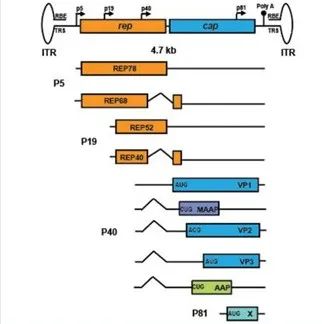
圖1. 野生型AAV2基因組組織。AAV2基因組是單鏈DNA (4.7 kb),有2個(gè)主要的開放閱讀框,兩側(cè)是T形倒置末端重復(fù)序列。P5和P19啟動(dòng)子驅(qū)動(dòng)兩個(gè)rep轉(zhuǎn)錄本的轉(zhuǎn)錄,這2個(gè)轉(zhuǎn)錄本經(jīng)過選擇性剪接 (曲線),導(dǎo)致2個(gè)大的rep蛋白 (Rep78和Rep68) 和2個(gè)小的rep蛋白 (Rep52和Rep40) 的表達(dá)。P40啟動(dòng)子控制cap轉(zhuǎn)錄本的轉(zhuǎn)錄和表達(dá)。可選的剪接 (曲線),使用非傳統(tǒng)的開始密碼子,和移位的開放閱讀框?qū)е?種不同的蛋白質(zhì)的表達(dá)。這些蛋白包括3種衣殼蛋白 (VP1、VP2和VP3)、組裝激活蛋白 (AAP) 和膜關(guān)聯(lián)蛋白 (MAAP)。p81啟動(dòng)子轉(zhuǎn)錄并控制基因X的表達(dá),該基因可能參與AAV的復(fù)制。RBE:Rep結(jié)合元件;ITR:反向末端重復(fù);Ploy (A):聚腺苷酸化信號(hào);TRS,終端解析點(diǎn)。
衣殼蛋白以 1:1:10 的比例 (VP1:VP2:VP3) 由2個(gè)交替剪接的 mRNA 產(chǎn)生,組裝由 60 個(gè)病毒蛋白亞基組成的衣殼。來自 P40 啟動(dòng)子轉(zhuǎn)錄物的次要剪接 RNA 變體包含 VP1 翻譯起始密碼子 (AUG),這解釋了其與 VP3 相比較低的表達(dá)水平。雖然主要剪接 RNA 變體包含 VP2 和 VP3 的翻譯起始位點(diǎn),但后者的翻譯是從傳統(tǒng)的 AUG 起始密碼子開始的,而前者是從一個(gè)非常規(guī)的 ACG 起始位點(diǎn)產(chǎn)生的,該位點(diǎn)經(jīng)常被跳過并導(dǎo)致 VP2 表達(dá)降低(圖 1)。VP1 的 N 末端還含有以磷脂酶 A2 (PLA2) 為代表的酶活性,這是 AAV 從內(nèi)體逃逸所必需的,并包含核定位信號(hào) (NLS)。帽區(qū)域還包含一個(gè)移碼開放閱讀框,編碼組裝激活蛋白 (AAP) 的非常規(guī)密碼子 CUG,在 VP 亞基蛋白轉(zhuǎn)運(yùn)至核仁區(qū)室和衣殼組裝過程中,該蛋白在大多數(shù) AAV 血清型中起重要作用。據(jù)報(bào)道,AAP 蛋白與衣殼蛋白的保守 C 末端相互作用,并作為組裝支架發(fā)揮作用。在帽區(qū)域還鑒定了另外2個(gè)開放閱讀框,編碼蛋白 X 和膜相關(guān)輔助蛋白 (MAAP)。雖然它們在 AAV 生物學(xué)中的確切功能仍不清楚,但它們可能分別參與增強(qiáng) AAV 的復(fù)制和分泌(圖 1)。rAAV 僅包含來自野生型病毒的 ITR,而復(fù)制和衣殼化的基本元素(rep 和 cap)被目的基因的表達(dá)盒替換。
當(dāng)前的重組腺相關(guān)病毒 (rAAV) 生產(chǎn)平臺(tái)
本文將討論5個(gè)主要生產(chǎn)平臺(tái),在 rAAV 質(zhì)量、產(chǎn)量、實(shí)施速度和可靠的可放大性方面,每種方法都有自己的優(yōu)點(diǎn)和缺點(diǎn)。最廣泛使用的平臺(tái)之一是用于 rAAV 生產(chǎn)的 HEK293 細(xì)胞瞬時(shí)轉(zhuǎn)染。其它常用的平臺(tái)包括桿狀病毒表達(dá)載體系統(tǒng) (BEVS) 和基于 HeLa 細(xì)胞的系統(tǒng),主要是因?yàn)樗鼈兛芍苯舆M(jìn)行大規(guī)模生產(chǎn)。另一個(gè)眾所周知的系統(tǒng)基于單純皰疹病毒 (HSV),它也可為 rAAV 生產(chǎn)提供直接的可放大性。最后一個(gè)平臺(tái)涉及在無輔助病毒系統(tǒng)中使用 HEK293 細(xì)胞或其它細(xì)胞類型進(jìn)行穩(wěn)定的細(xì)胞系開發(fā),而不在生產(chǎn)中使用腺病毒、BEVS、HeLa 或 HSV;這已成為最近的熱門話題,并取得了實(shí)質(zhì)性進(jìn)展。
為了克服當(dāng)前 rAAV 生產(chǎn)平臺(tái)面臨的瓶頸,多個(gè)研究小組已經(jīng)探索了使用替代宿主進(jìn)行 rAAV 生產(chǎn)的可行性,例如E.Coli和釀酒酵母,其擁有完善的蛋白質(zhì)生產(chǎn)平臺(tái),商品成本低。最近的一項(xiàng)研究表明,AAV2 VP3 衣殼亞基可在E.Coli中表達(dá)并成功組裝,具有與通過HEK293 瞬時(shí)轉(zhuǎn)染工藝產(chǎn)生的 rAAV2 相似的物理和生化特性。由于缺乏適當(dāng)?shù)牡鞍踪|(zhì)折疊和翻譯后修飾, 其它研究小組探索使用釀酒酵母作為另一種生產(chǎn) rAAV 的替代方法,并簡化下游工藝。使用編碼 Rep78、Rep52、衣殼 VP1、VP2、VP3 和 AAP 的4種質(zhì)粒轉(zhuǎn)化酵母細(xì)胞,研究小組觀察了到 rAAV 的正確組裝,但與更發(fā)達(dá)的 Sf9/桿狀病毒系統(tǒng)產(chǎn)生的 rAAV 相比,完整顆粒百分比和感染性較低。酵母系統(tǒng)的未來研究重點(diǎn)是識(shí)別參與衣殼組裝、AAV 復(fù)制和包裝的酵母宿主因子,這將有助于開發(fā)更好的酵母系統(tǒng),實(shí)現(xiàn)更具可放大性和成本效益的AAV生產(chǎn)。
基于 HEK293 的 rAAV 生產(chǎn)系統(tǒng)
rAAV 最初是通過瞬時(shí)轉(zhuǎn)染3種質(zhì)粒生產(chǎn),其攜帶在 HEK293 或 HEK293T 宿主細(xì)胞中組裝 rAAV 的必需基因,細(xì)胞穩(wěn)定表達(dá)腺病毒 E1A 和 E1B 基因的轉(zhuǎn)染 DNA,支持 AAV 復(fù)制。雖然與 HEK293 細(xì)胞相比, HEK293T 細(xì)胞具有更快的生長速率以及更好的可轉(zhuǎn)染性,且rAAV 產(chǎn)量更高,但SV40 T 抗原腫瘤蛋白的存在會(huì)導(dǎo)致安全風(fēng)險(xiǎn)。來自 E1A 的編碼蛋白通過反式激活 P5 和 P19 啟動(dòng)子來增加 rep 表達(dá)。除了編碼 rep 和 cap 的第2個(gè)質(zhì)粒和包含2側(cè)含有2個(gè)倒置表達(dá)盒的第3個(gè)質(zhì)粒之外,在1個(gè)質(zhì)粒上提供其余的必要腺病毒輔助基因(E4、E2A 和病毒相關(guān) (VA) RNA)末端重復(fù)序列 (ITR),防止 rAAV 生產(chǎn)過程中的腺病毒污染(圖 2A)。
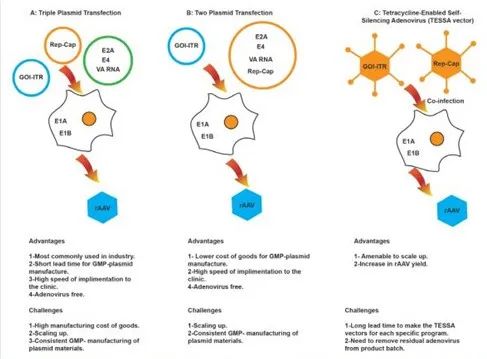
圖2. 基于HEK293的rAAV生產(chǎn)平臺(tái)。每個(gè)平臺(tái)的簡化rAAV生產(chǎn)工作流程,展示rAAV生產(chǎn)中涉及的每個(gè)基本步驟。(A) 三質(zhì)粒轉(zhuǎn)染。(B) 兩質(zhì)粒轉(zhuǎn)染。(C) 基于四環(huán)素的自沉默腺病毒 (TESSA載體)。總結(jié)了每種工藝的優(yōu)點(diǎn)和挑戰(zhàn)。GOI:目的基因;ITR,反向末端重復(fù)。
A)三質(zhì)粒轉(zhuǎn)染:優(yōu)勢:1- 最常用于工業(yè),2- GMP質(zhì)粒生產(chǎn)時(shí)間短,3- 臨床實(shí)施速度快,4- 無需腺病毒;挑戰(zhàn):1- 商品生產(chǎn)成本高,2- 規(guī)模放大挑戰(zhàn),3- 質(zhì)粒材料的一致GMP生產(chǎn)。
B)兩質(zhì)粒轉(zhuǎn)染:優(yōu)勢:1- GMP質(zhì)粒生產(chǎn)成本降低,2 - 臨床實(shí)施速度快,3- 無需腺病毒;挑戰(zhàn):1- 規(guī)模放大,2- 質(zhì)粒材料的一致GMP生產(chǎn)。
C)TESSA載體:優(yōu)勢:1- 可規(guī)模放大,2- 提高rAAV產(chǎn)量;挑戰(zhàn):1- 需針對(duì)每個(gè)項(xiàng)目制備TESSA載體,延長了時(shí)間線,2-需要從生產(chǎn)批次中去除殘留的腺病毒。
傳統(tǒng)上,貼壁 HEK293 細(xì)胞被用于 rAAV 生產(chǎn)的三質(zhì)粒轉(zhuǎn)染方法,這為初步臨床試驗(yàn)產(chǎn)生了足夠的 rAAV。行業(yè)已經(jīng)開發(fā)了一些新方法,以從貼壁 HEK293 細(xì)胞轉(zhuǎn)移到無血清懸浮培養(yǎng)。這種馴化工作規(guī)避了貼壁瞬時(shí)轉(zhuǎn)染技術(shù)規(guī)模放大的挑戰(zhàn)。
腺相關(guān)病毒是一種依賴型細(xì)小病毒,需要多種宿主因子和輔助病毒提供的必要基因才能復(fù)制。除腺病毒外,還鑒定和表征了幾種輔助病毒,以支持增殖,例如針對(duì)哺乳動(dòng)物細(xì)胞生產(chǎn)的單純皰疹病毒、牛痘病毒、針對(duì)昆蟲細(xì)胞生產(chǎn)的桿狀病毒。Wang 等人發(fā)現(xiàn),人博卡病毒 1 (HBoV1) 是 AAV2 復(fù)制的新型輔助病毒,AAV2 復(fù)制的最低要求包括 HBoV1、NP1 和 NS4 非結(jié)構(gòu)蛋白,以及病毒長鏈非編碼 RNA (BocaSR)。同一團(tuán)隊(duì)的一項(xiàng)研究表明,將人博卡病毒輔助基因(NP1 和 NS4)與腺病毒輔助必要基因(E4、E2A 和 VA RNA)相結(jié)合,在三質(zhì)粒瞬時(shí)轉(zhuǎn)染方法中,獲得的產(chǎn)量大約是單獨(dú)使用腺病毒輔助質(zhì)粒的2倍.
三質(zhì)粒轉(zhuǎn)染系統(tǒng)已經(jīng)非常成熟,通常用于臨床和商業(yè)化生產(chǎn)。幾個(gè)研究小組試圖引入雙質(zhì)粒系統(tǒng),以縮短生產(chǎn) GMP 產(chǎn)品所需的時(shí)間,并降低產(chǎn)品成本,同時(shí)簡化瞬時(shí)轉(zhuǎn)染工藝(圖 2B)。Grimm 等人引入了第1個(gè)雙質(zhì)粒表達(dá)系統(tǒng),他們在其中設(shè)計(jì)了一種新的包裝/輔助質(zhì)粒 pDG,以包括 AAV 復(fù)制、衣殼形成和輔助功能所需的rep、cap、E4、E2A 和 VA RNA 基因。在該質(zhì)粒中,p5 啟動(dòng)子被誘導(dǎo)型小鼠乳腺腫瘤病毒 (MMTV) 啟動(dòng)子取代,以削弱 Rep 蛋白表達(dá)。用 pDG 質(zhì)粒和轉(zhuǎn)基因載體質(zhì)粒共轉(zhuǎn)染細(xì)胞足以產(chǎn)生 AAV。作者報(bào)告說,這種雙質(zhì)粒系統(tǒng)產(chǎn)生的 AAV 滴度比傳統(tǒng)的三質(zhì)粒轉(zhuǎn)染系統(tǒng)高 10 倍。使用類似的方法中,Tang 等人對(duì) pDG 質(zhì)粒的骨架進(jìn)行了進(jìn)一步修改,以創(chuàng)建包括rAAV 生產(chǎn)所需的基本腺病毒輔助基因之外,包含 AAV rep 和 cap 的 pQT 包裝質(zhì)粒。他們使用不同的 AAV 血清型(包括 AAV1、AAV5、AAV8 和 AAV9),將 pQT 系統(tǒng)與傳統(tǒng)三質(zhì)粒系統(tǒng)進(jìn)行了比較,發(fā)現(xiàn) pQT 系統(tǒng)的功能與三質(zhì)粒轉(zhuǎn)染系統(tǒng)相似,并且對(duì)于GMP生產(chǎn),在速度和成本效益方面更靈活。
最近,Su等人介紹了一種適合規(guī)模放大的、自衰減腺病毒系統(tǒng),與傳統(tǒng)的瞬時(shí)轉(zhuǎn)染方法相比,該系統(tǒng)使一系列血清型的 rAAV 產(chǎn)量提高了 10 到 30 倍(圖 2C)。在這個(gè)系統(tǒng)中,研究人員能夠通過打開/關(guān)閉負(fù)責(zé) rAAV 生產(chǎn)和腺病毒結(jié)構(gòu)蛋白表達(dá)的輔助功能的早期和晚期時(shí)間階段,從而控制輔助腺病毒的生命周期。這是通過插入四環(huán)素操縱子 TetO 來設(shè)計(jì)腺病毒主要晚期啟動(dòng)子 (MLP) 而實(shí)現(xiàn)的,TetO 可以用主要晚期啟動(dòng)子表達(dá)的 TetR 阻遏物來抑制。這種設(shè)計(jì)創(chuàng)造了一個(gè)負(fù)反饋回路來調(diào)節(jié)腺病毒結(jié)構(gòu)基因的表達(dá),這些基因由多西環(huán)素存在與否控制。rAAV 生產(chǎn)是通過用基于四環(huán)素的自沉默腺病毒(TESSA 載體)感染 HEK293 細(xì)胞來實(shí)現(xiàn)的,提供具有輔助功能的早期基因表達(dá),其中穩(wěn)定摻入側(cè)翼為 ITR 的 AAV 轉(zhuǎn)基因,同時(shí)提供在同一區(qū)域含有 AAV rep和cap基因的第2個(gè) TESSA 載體。盡管該系統(tǒng)顯示出比傳統(tǒng)的三質(zhì)粒轉(zhuǎn)染更高的 rAAV 產(chǎn)量并且可以規(guī)模放大,但仍然有低水平的腺病毒污染。這可能是由于強(qiáng)力霉素調(diào)節(jié)啟動(dòng)子的固有滲漏性。此外,研究已經(jīng)表明,在沒有腺病毒主要晚期啟動(dòng)子 (MLP) 的情況下,一種腺病毒纖維蛋白以非常低的水平從隱蔽啟動(dòng)子表達(dá)。在下游工藝過程中可以完全清除殘留的腺病毒污染,以確保安全。
新技術(shù)將進(jìn)一步實(shí)現(xiàn)瞬時(shí)轉(zhuǎn)染的可放大性并提高 rAAV 質(zhì)量,例如使用無質(zhì)粒瞬時(shí)轉(zhuǎn)染和納米質(zhì)粒平臺(tái)。除了實(shí)施無質(zhì)粒平臺(tái)外,其他研究人員還在探索支持高轉(zhuǎn)染效率以及在大規(guī)模生物反應(yīng)器中獲得高生產(chǎn)率的新型轉(zhuǎn)染試劑。
原文:P.Liu, A.Mayer, Advances in Recombinant Adeno-Associated Virus Production for Gene Therapy. American Pharmaceutical Review, 2022.






