近年來,腺相關(guān)病毒 (AAV) 作為基因和細胞治療載體的使用顯著增加。因此,概念驗證和臨床試驗期間所需的 AAV 載體數(shù)量也有所增加。AAV 血清型 6 (AAV6) 因其在轉(zhuǎn)導(dǎo)不同細胞類型方面的效率而得到充分證明,并已成功用于基因和細胞治療方案。然而,據(jù)估計,將轉(zhuǎn)基因有效遞送至單個細胞所需的載體數(shù)量為 10^6 VG (病毒基因組)。總體而言,這意味著需要大規(guī)模生產(chǎn) AAV6。基于懸浮細胞的平臺目前僅限于低細胞密度生產(chǎn),阻礙了該生產(chǎn)工藝提高產(chǎn)量的潛力。在這里,我們研究了在更高細胞密度下,提高 AAV6 產(chǎn)量的方案。通過瞬時轉(zhuǎn)染 HEK293SF 細胞進行生產(chǎn)。當(dāng)以細胞為基礎(chǔ)提供質(zhì)粒 DNA 時,可以在中等細胞密度下進行生產(chǎn),而不會影響細胞特異性滴度或顆粒功能,從而使滴度高于 10^10 VG/mL。就 VG/cell而言,在高細胞密度生產(chǎn)中,培養(yǎng)基添加減輕了細胞密度效應(yīng)。另一方面,細胞特異性功能滴度沒有得到維持,需要進一步研究以了解觀察到的局限性。此處報告的中等細胞密度生產(chǎn)方法為大規(guī)模工藝操作奠定了基礎(chǔ),有可能解決當(dāng)前 AAV 生產(chǎn)中的載體短缺問題。
腺相關(guān)病毒 (AAV) 是一種小的、25 nm寬、二十面體、無囊膜的病毒,具有 4.7 kb長的單鏈 DNA 基因組,屬于細小病毒科。AAV 是非致病性和復(fù)制缺陷型,這取決于與輔助病毒(如腺病毒或單純皰疹病毒)的共同感染。AAV 于 1960 年代首次從腺病毒庫中發(fā)現(xiàn),最近已成為治療疾病的關(guān)鍵基因遞送載體。Glybera 是歐洲藥品管理局于 2012 年批準(zhǔn)的第一個基于 AAV 的基因治療藥物。美國食品和藥物管理局 (FDA) 于 2017 年批準(zhǔn)了基于 AAV 的基因治療藥物 Luxturna,并于 2019 年批準(zhǔn)了 Zolgesma。
迄今為止,基于系統(tǒng)發(fā)育分析,已鑒定出 13 種不同的血清型和 100 多種 AAV 變體。由于衣殼蛋白的異質(zhì)性,每種血清型都表現(xiàn)出不同的趨向性以及轉(zhuǎn)導(dǎo)不同細胞類型的能力。血清型 6 具有廣泛的靶細胞,已顯示可成功轉(zhuǎn)導(dǎo)中樞神經(jīng)系統(tǒng)、人前列腺癌、乳腺癌和肝癌細胞、黑素細胞、骨骼肌、心臟、肺和眼部的細胞。最近,AAV6 因其轉(zhuǎn)導(dǎo)淋巴細胞的能力及其用于生成嵌合抗原受體 T 細胞的用途而受到歡迎。
行業(yè)正在研究的治療性 AAV 應(yīng)用的數(shù)量正在穩(wěn)步增加,有超過 300 項已完成或正在進行的臨床試驗。這些應(yīng)用需要大量 AAV 載體來驗證臨床前動物研究和臨床試驗。報告的靶向給藥劑量最高可達 7.5 x 10^15 VG,全身給藥最高可達 1.5 x 10^17 VG。這種對病毒載體數(shù)量的巨大需求意味著有必要改進當(dāng)前的生產(chǎn)方法。對于 AAV 血清型 6 尤其如此,它在 T 細胞轉(zhuǎn)導(dǎo)期間需要高達 10^6 VG/cell。重組 AAV 是通過用目的基因 (GOI) 替換病毒基因 Rep 和 Cap 而產(chǎn)生的。哺乳動物細胞瞬時轉(zhuǎn)染一個 GOI 盒,GOI 盒兩側(cè)是反向末端重復(fù)序列,一個攜帶 Rep 和 Cap 功能的質(zhì)粒,以及編碼輔助功能的第三個質(zhì)粒。瞬時轉(zhuǎn)染通常使用具有成本效益的陽離子聚合物 - 聚乙烯亞胺 (PEI) 完成。然而,對于超過 10^15 VG 的 AAV 生產(chǎn)規(guī)模,貼壁細胞培養(yǎng)被認(rèn)為是不可行的,這使得它們不適合這些病毒載體的后期臨床試驗和商業(yè)應(yīng)用。2006 年有研究首次描述了使用懸浮 HEK293 細胞生產(chǎn) AAV 載體的方案。盡管在優(yōu)化生產(chǎn)方面做出了許多努力,但 AAV 載體的大規(guī)模生產(chǎn)被認(rèn)為是其作為基因治療和細胞治療的病毒載體而實施的瓶頸,主要是因為目前基于 HEK293 的生產(chǎn)是在低細胞密度條件下完成的。將病毒載體的生產(chǎn)限制在低細胞密度條件下,阻礙了這種生產(chǎn)工藝得到強化的潛力。另一方面,在較高細胞密度下生產(chǎn)病毒載體往往會受到廣泛報道的細胞密度效應(yīng) (CDE) 的限制,這會導(dǎo)致轉(zhuǎn)染和生產(chǎn)力下降。在本研究中,我們證明了通過瞬時轉(zhuǎn)染生產(chǎn) AAV 血清型 6 且不局限于低細胞密度培養(yǎng)的方案。
詳細試驗操作和結(jié)果,請參考原文。
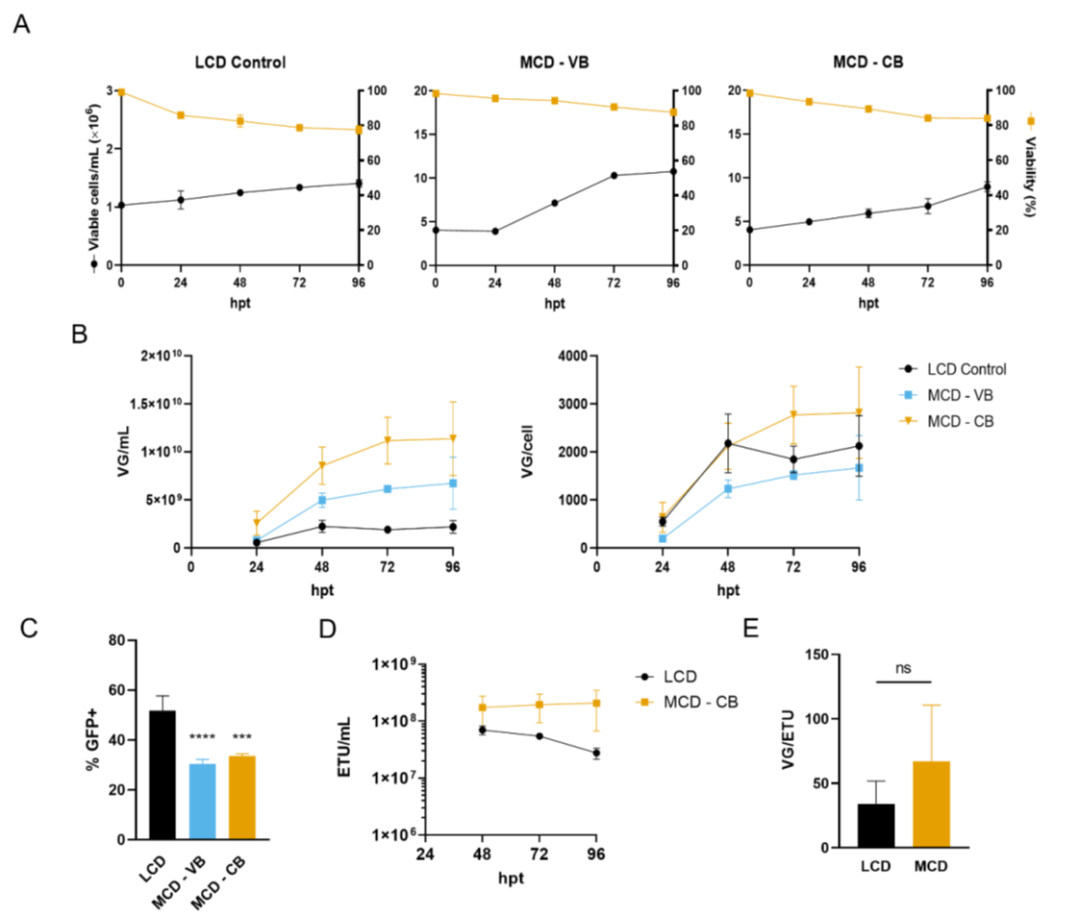
圖2. 在中等細胞密度條件下,通過三質(zhì)粒轉(zhuǎn)染,生產(chǎn)AAV6。
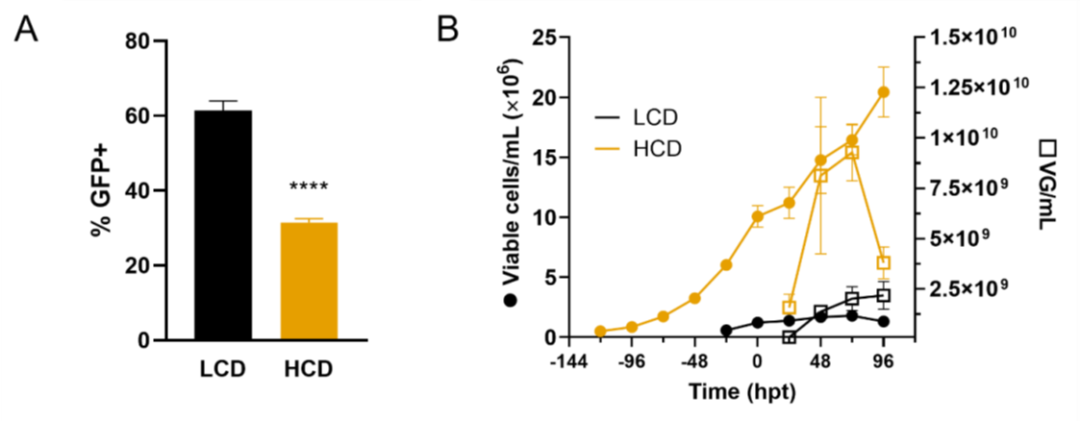
圖3. 在高細胞密度條件下,通過三質(zhì)粒轉(zhuǎn)染,生產(chǎn)AAV6。
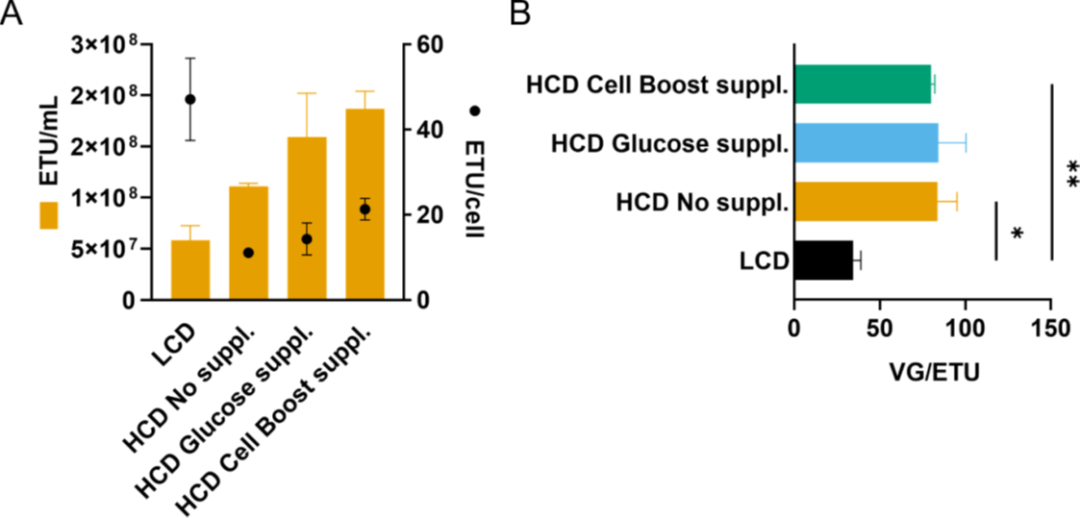
圖6. 在不同細胞密度條件下,AAV6的生產(chǎn)。
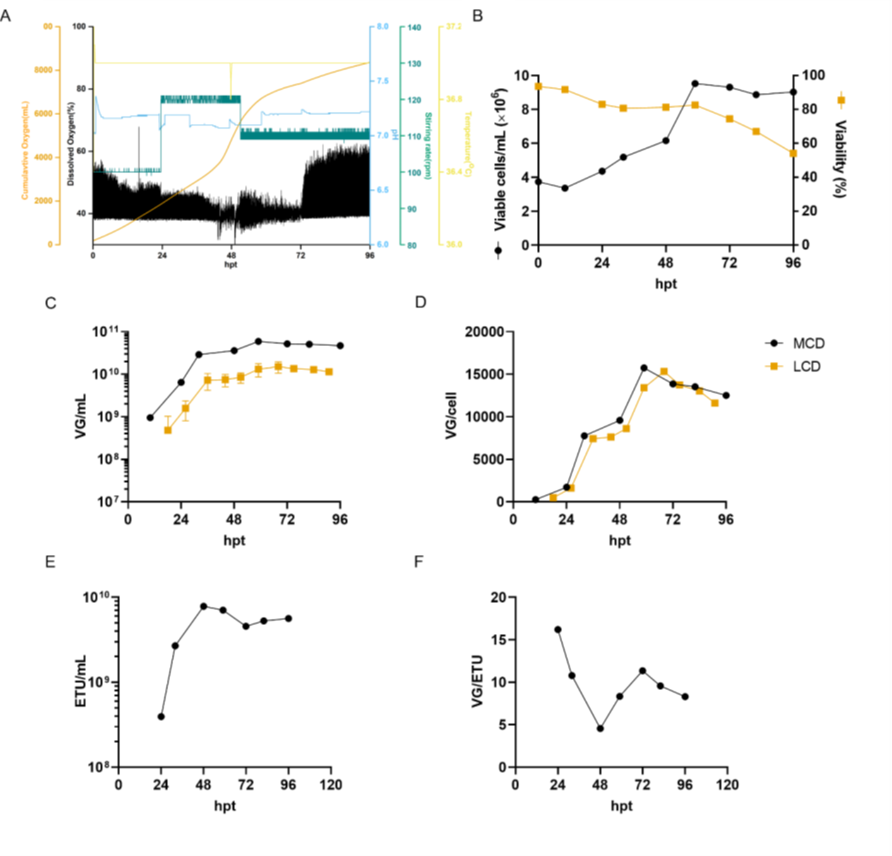
圖7. 在中等細胞密度下,AAV6的生物反應(yīng)器生產(chǎn)。
討論
在圖 1 中,我們觀察到當(dāng)轉(zhuǎn)染時的細胞密度從 1 增加到 2 x 106 cell/mL時,質(zhì)粒 DNA 可用性在維持 VG 滴度方面起著重要作用。在低細胞密度瞬時轉(zhuǎn)染中,質(zhì)粒 DNA 通常以體積為基礎(chǔ)進行遞送。與我們的研究一樣。Grieger、Soltys 和 Samulski 也觀察到當(dāng)細胞密度和質(zhì)粒濃度加倍時,生產(chǎn)過程中的滴度增加。對于 4 x 106 cells/mL(中等細胞密度,MCD)的生產(chǎn),還觀察到需要更高的質(zhì)粒 DNA 濃度。轉(zhuǎn)染時細胞數(shù)量增加 4 倍導(dǎo)致病毒滴度 (VG/mL) 幾乎呈線性增加(圖 2B)。此外,在 MCD 生產(chǎn)過程中保持了細胞特異性生產(chǎn)率,質(zhì)粒 DNA 濃度保持在每個細胞的基礎(chǔ)上(圖 2B)。獲得了 1,500 至 3,000 VG/cell的產(chǎn)率,與 Chahal、Schulze、Tran、Montes 和 Kamen 報道的產(chǎn)率相似。還觀察到功能性顆粒 (ETU) 滴度的提高。以細胞為基礎(chǔ)遞送質(zhì)粒 DNA 的 MCD 生產(chǎn)的功能性滴度保持不變(圖 2D),與 96 hpt 的 LCD 對照相比,差異高達 3.9 倍。在 LCD 上,轉(zhuǎn)導(dǎo)單元略有減少,但含有基因組的顆粒沒有減少,這可以用病毒載體功能的喪失來解釋。AAV 載體是熱穩(wěn)定性的,但當(dāng)維持在 37°C 且 pH 值降低時,它們的轉(zhuǎn)導(dǎo)效率會降低。由于氨和乳酸等代謝物的積累,將培養(yǎng)延長至 96 hpt 可降低細胞內(nèi)和細胞外 pH 值。
VG/ETU 比率衡量病毒功能,顯示能夠轉(zhuǎn)導(dǎo)靶細胞的含有基因組的病毒的比例。在 48 hpt 時,MCD 生產(chǎn)的平均 VG/ETU 比率為 67.1(圖 2E)。盡管該值高于文獻中報道的值,但與我們的 LCD 對照組沒有統(tǒng)計學(xué)上的顯著差異。如圖 7 所示,中等細胞密度的 AAV6 生產(chǎn)在 3 L 生物反應(yīng)器中成功進行。將細胞以 4 x 10^6 cells/mL 的所需細胞密度接種到含有新鮮培養(yǎng)基的生物反應(yīng)器中,以防止耗竭的培養(yǎng)基產(chǎn)生不利影響。在更大規(guī)模上,這可以通過使用切向流深層過濾 (TFDF) 等作為細胞截留裝置的培養(yǎng)基置換策略來實現(xiàn)。與之前報道的類似規(guī)模化生產(chǎn)相比,這種生物反應(yīng)器生產(chǎn)分別導(dǎo)致 VG/mL 和 VG/cell滴度增加 30 倍和 7.5 倍。令人驚訝的是,生物反應(yīng)器上的病毒載體產(chǎn)率比小規(guī)模衛(wèi)星培養(yǎng)高約 10 倍。同樣,LCD 生物反應(yīng)器生產(chǎn)也顯示出比小規(guī)模實驗更高的產(chǎn)率。生物反應(yīng)器中產(chǎn)率的提高可能與更好地調(diào)節(jié)培養(yǎng)條件有關(guān),例如溶氧和 pH 值。同樣,沒有觀察到功能性滴度的損失,轉(zhuǎn)染后 48 小時達到最大值 7.8 x 10^9 ETU/mL,VG/ETU 比率為 4.6(圖 7D 和 E)。這些結(jié)果表明比以前的報告有所改進。
當(dāng)生產(chǎn)在 1 x 10^6 cells/mL 以外的細胞密度下進行時,轉(zhuǎn)染效率(通過轉(zhuǎn)染后 24 小時的轉(zhuǎn)基因表達測量)降低至約 30%,不同細胞密度的情況相似(圖 1B、圖 2C、和圖 3A)。然而,表達轉(zhuǎn)基因的細胞百分比與生產(chǎn)效率沒有直接關(guān)聯(lián)。其他研究小組在通過瞬時轉(zhuǎn)染 HEK293SF 懸浮細胞產(chǎn)生病毒樣顆粒的工藝中也觀察到了同樣的現(xiàn)象。Hildinger、Baldi、Stettler 和 Wurm 得出結(jié)論,轉(zhuǎn)染效率的降低是由基于體積的 DNA 供應(yīng)造成的。然而,在我們的研究中增加質(zhì)粒 DNA 可用性并沒有顯著提高轉(zhuǎn)導(dǎo)效率(圖 1B、圖 2C 和圖 3A),這是通過檢測三種質(zhì)粒之一的產(chǎn)物來衡量的,這證實了之前的發(fā)現(xiàn)。據(jù)報道,能量需求增加會發(fā)生在較高的細胞密度下,并允許從轉(zhuǎn)染中恢復(fù),這是一種已知具有細胞毒性的事件。在類似灌流模式的生產(chǎn)工藝中,轉(zhuǎn)染效率沒有提高,即使補充了培養(yǎng)基(圖 5B)也是如此。在較高的葡萄糖濃度下轉(zhuǎn)染效率甚至更低。Lavado-García、Jorge、Cervera、Vázquez 和 Godia 部分解釋了低轉(zhuǎn)染效率是由于參與脂質(zhì)生物合成和細胞內(nèi)蛋白質(zhì)核轉(zhuǎn)運的途徑下調(diào)所致。轉(zhuǎn)染步驟本身是 AAV 載體生產(chǎn)中的一個已知瓶頸。我們小組最近的一項研究表明,盡管轉(zhuǎn)導(dǎo)效率很高,但產(chǎn)生病毒顆粒的細胞比例低至 7%。
最近,報道了采用培養(yǎng)基置換策略在高細胞密度下提高 AAV8 產(chǎn)量。相反,細胞密度效應(yīng)在我們的高細胞密度生產(chǎn)工藝中得到證實(圖 3B 和 5)。 CDE 是指在高細胞密度下由于細胞特異性生產(chǎn)力降低而導(dǎo)致的產(chǎn)量下降。先前已經(jīng)記錄了使用其它生產(chǎn)系統(tǒng)(例如昆蟲細胞)生產(chǎn) AAV 時的這種效果。在生產(chǎn)過程中,25% 到 30% 的 AVV6 載體會釋放到上清液中。由于高細胞密度以及提高振蕩速度以適當(dāng)為生物反應(yīng)器供氧,因此細胞可能處于增加的純應(yīng)力下,并且可能已將更多載體釋放到上清液中,這些載體在培養(yǎng)基置換期間被去除。這可以解釋在 HCD 生產(chǎn)中病毒滴度在 96 hpt 時突然下降(圖 3B),這是意料之外的,因為 AAV 載體被認(rèn)為在很寬的溫度范圍內(nèi)非常穩(wěn)定。然而,同樣的下降,補充培養(yǎng)基時未觀察到 (圖 5C)。
細胞密度效應(yīng)被認(rèn)為主要是由于低濃度營養(yǎng)物或抑制性代謝物積累引起的代謝限制所致。在 HCD 的生產(chǎn)工藝中,采用了類似灌流的模式來提供足夠的營養(yǎng),以支持高細胞密度并去除抑制性代謝物;然而,所選擇的條件不足以防止 CDE(圖 3)。盡管每天完全置換培養(yǎng)基,但在 HCD 時葡萄糖水平顯著下降。出于這個原因,基礎(chǔ)培養(yǎng)基 HyCell TransFx-H 含有約 6 g/L 的葡萄糖,并添加了葡萄糖或 Cells Boost 5。添加的量取決于細胞特異性葡萄糖消耗率,因此在任何給定時間都至少有 2 g/L 的葡萄糖可用,模仿在 LCD 產(chǎn)品中觀察到的葡萄糖濃度。單獨添加葡萄糖的培養(yǎng)基并不能恢復(fù) AAV6 的細胞特異性生產(chǎn)力(圖 5C)。CDE 得到緩解,并且僅當(dāng)使用補充有 15% Cell Boost 5 的培養(yǎng)基時才能恢復(fù)細胞特異性生產(chǎn)力(VG/cell)(圖 5C),這表明其它關(guān)鍵營養(yǎng)素限制了病毒載體生產(chǎn)。除了葡萄糖,Cell Boost 5 添加物的其它成分被認(rèn)為有助于緩解 CDE。在使用 HEK293SF 細胞生產(chǎn)腺病毒載體時,Shen、Voyer、Tom 和 Kamen 強調(diào)所用培養(yǎng)基的組成對于支持 HCD 的高產(chǎn)率至關(guān)重要。然而,培養(yǎng)基和添加物的復(fù)雜性,例如 Cell Boost 5,它可以包含數(shù)百種不同濃度的不同成分,使對單個營養(yǎng)素對病毒載體生產(chǎn)的影響的理解變得復(fù)雜。優(yōu)化細胞培養(yǎng)基,可以在生產(chǎn)AAV 載體時,提高滴度和載體質(zhì)量,正如其它病毒載體中所見和所建議的那樣。
如上所述,在培養(yǎng)基中添加 Cell Boost 5 可在含基因組顆粒方面減輕對細胞密度的影響;然而,對于功能性顆粒卻沒有觀察到同樣的情況。雖然補充培養(yǎng)基后功能性產(chǎn)量有所增加,但細胞特異性功能滴度(ETU/cell)并未完全保持,導(dǎo)致與 LCD 對照相比更高的 VG/ETU 比率(圖 6)。一種可能的解釋是病毒衣殼的錯誤組裝,其化學(xué)計量比為 1:1:10 (VP1:VP2:VP3)。如果這個比例發(fā)生改變,AAV 遞送轉(zhuǎn)基因的功效就會降低。由于核定位信號,VP1 和 VP2 蛋白在轉(zhuǎn)導(dǎo)中起著至關(guān)重要的作用,特別是在核轉(zhuǎn)運中。VP1 的 N 末端還包含一個磷脂酶 A2 結(jié)構(gòu)域,負(fù)責(zé)病毒從核內(nèi)體中逃逸。我們的結(jié)果強調(diào)了通過測量生物活性載體評估病毒轉(zhuǎn)導(dǎo)功效的重要性,作為優(yōu)化 AAV 載體生產(chǎn)的一部分。盡管病毒載體的質(zhì)量屬性(包括功能滴度)是 FDA 推薦的效力測試的重要組成部分,但研究人員有時會忽略這種測量。
總之,我們證明可以在中等細胞密度下通過三質(zhì)粒瞬時轉(zhuǎn)染產(chǎn)生 AAV6,而不會損失細胞特異性生產(chǎn)力或功能滴度。為此,必須以細胞為基礎(chǔ)提供質(zhì)粒 DNA。我們的中等細胞密度產(chǎn)品達到了 10^10 VG/mL 粗裂解液滴度。與完善的生產(chǎn)方案相比,通過這種方法獲得的產(chǎn)量顯著增加。本研究中描述的用于 AAV 載體生產(chǎn)的中等細胞密度方法被證明在 3 L 生物反應(yīng)器規(guī)模上是有效的。它可以用作大規(guī)模生產(chǎn)工藝的基礎(chǔ),可能有助于解決當(dāng)前 AAV 生產(chǎn)中的載體短缺問題。當(dāng)使用補充培養(yǎng)基進行類似灌流的操作時,細胞密度效應(yīng)可以在更高的細胞密度下得到緩解,從而導(dǎo)致相似的細胞特異性生產(chǎn)率(VG/cell)。然而,細胞特異性功能生產(chǎn)率(ETU/cell)減少,突出了在生物工藝優(yōu)化過程中評估病毒基因組和轉(zhuǎn)導(dǎo)單元的重要性。需要進一步研究,以充分了解細胞密度效應(yīng)如何導(dǎo)致功能滴度降低,以及如何完全緩解這種現(xiàn)象。
原文:P. Moco, X. Xu, A. Kamen, High-cell-density production of adeno-associated viral vector serotype 6 by triple transfection in suspension HEK293 cell cultures. 2023.






